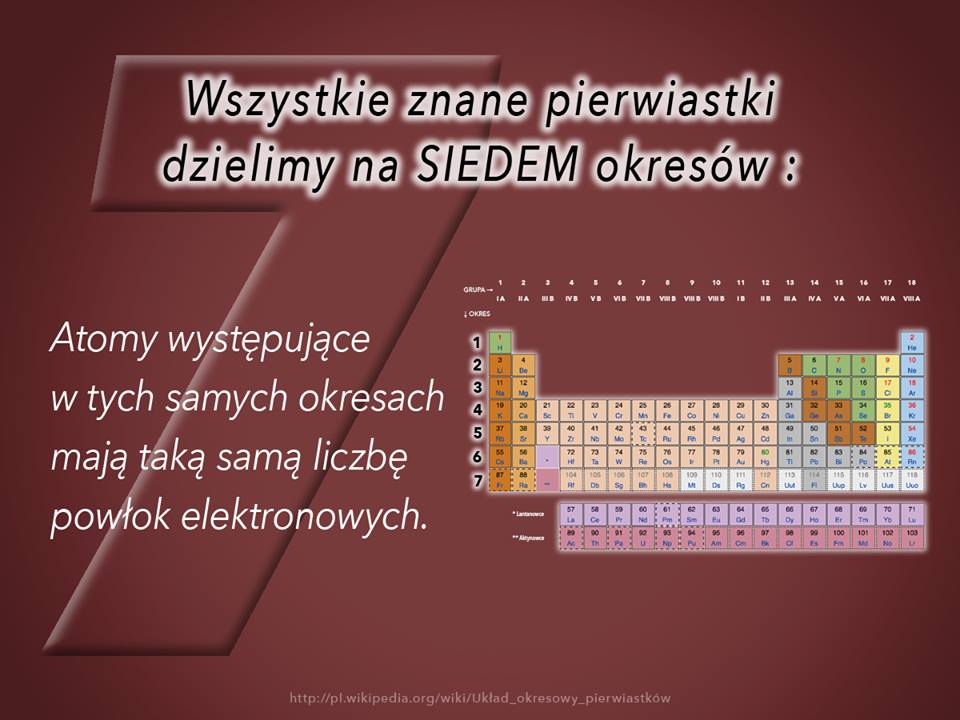
Wszystkie znane pierwiastki dzielimy na SIEDEM okresów
Bóg ma dwie księgi objawienia: stworzenie oraz Biblię. Stwierdzamy, że jako Autor obydwóch, wplótł On w obydwie te księgi liczbę 7. Nie jest zaskakujące, że ten sam Autor używa wspólnej kluczowej liczby jako znaku Swego autorstwa w obydwu z nich. W niniejszej serii zauważymy różne obszary natury, w których liczba 7 objawia Go jako Autora materialnego stworzenia – niektóre z nich są bardzo oczywiste, inne nieco ukryte, a wszystkie razem wzięte – wspaniałe.
Autor: br. P.O.
Część 15 – Wszystkie znane pierwiastki dzielimy na SIEDEM okresów – atomy występujące w tych samych okresach mają taką samą liczbę powłok elektronowych:
Fragment opisu z Wikipedii (https://pl.wikipedia.org/wiki/Układ_okresowy_pierwiastków):
„(…) Prawo okresowości Mendelejewa, stanowiące podstawę teoretyczną układu, wynika z faktu, że liczba atomowa określa nie tylko liczbę protonów, występujących w jądrze atomów, ale też liczbę elektronów atomów w stanie obojętnym, która ma decydujący wpływ na ich właściwości chemiczne.
Elektrony w atomach są umiejscowione na kolejnych powłokach, które mają określoną pojemność, czyli maksymalną liczbę elektronów, jaka może się zmieścić na powłoce. Kolejne powłoki są zajmowane przez elektrony dopiero po całkowitym zapełnieniu powłok leżących poniżej (o mniejszej energii). Zjawisko „zapełniania” powłok wynika z „zakazu Pauliego”, który w stosunku do atomów stwierdza, że na jednym orbitalu mogą znajdować się najwyżej dwa elektrony różniące się spinem. Elektrony na ostatniej, najbardziej zewnętrznej powłoce, nazywanej powłoką walencyjną, są najsłabiej związane z atomem i mogą odrywać się od niego podczas tworzenia wiązań chemicznych. Powłoka ta może przyjmować też dodatkowe elektrony, a ich energia wiązania ma kluczowe znaczenie przy powstawaniu związków chemicznych. Elektrony niżej leżące rzadziej uczestniczą w reakcjach chemicznych.
W obrębie jednego okresu powłoka walencyjna jest zajmowana przez kolejne elektrony. Po zapełnieniu całej powłoki następuje przejście do nowego okresu i powstanie kolejnej powłoki elektronowej.
Można więc powiedzieć, że atomy występujące w tych samych okresach mają taką samą liczbę powłok elektronowych, a występujące w tych samych grupach mają taką samą liczbę elektronów na powłokach walencyjnych.
(…)
Jeśli uznać, że układ okresowy to lista pierwiastków, ułożona względem ich mas atomowych i jednocześnie poukładanych w okresy, to pierwszą osobą, która dokonała takiego uporządkowania był francuski geolog Alexandre-Émile Béguyer de Chancourtois, który w 1863 roku opublikował tzw. „bęben pierwiastków” (inaczej „śrubę telluryczną”; łac. tellus – ziemia). Narysował on na bębnie spiralnie wznoszący się łańcuch nazw pierwiastków. Średnica bębna była tak dobrana, że łańcuch tworzył pełen obrót spirali co osiem pierwiastków. Dzięki temu, patrząc wzdłuż linii prostopadłych do podstawy bębna na jego powierzchni bocznej widziało się zawsze pierwiastki o podobnych właściwościach chemicznych. „Wynalazek” bębna chemicznego jednak nikogo nie zainteresował i wydawał się zwykłym dziwactwem.
Większy odzew uzyskało opublikowanie przez Johna Newlandsa jasno sformułowanego prawa okresowości w 1864 roku. Newlands stwierdził, że jeśli utworzyć listę pierwiastków według wzrastających mas atomowych (od wodoru do wapnia) to ich właściwości powtarzają się w cyklu co osiem pierwiastków. Nazwał to prawem oktawy, na zasadzie skojarzenia z oktawami muzycznymi. Nie potrafił tylko wyjaśnić, co ma wspólnego muzyka z pierwiastkami.
Współcześni Döbereinera, Chancourtois i Newlandsa wyśmiewali zwykle takie próby, bo wyglądały one na zabawę i kojarzyły się z numerologią. Wydawało im się, że równie dobrze można by doszukiwać się jakichś powtarzalności w liście pierwiastków ułożonych np. alfabetycznie.
Za twórcę układu okresowego uważa się powszechnie Rosjanina Dmitrija Mendelejewa. Uczony ten nie musiał się przejmować poglądami swoich współczesnych i dlatego dość swobodnie próbował układać pierwiastki w tabele, oparte na porządkowaniu ich w oparciu o ich masy atomowe. Po kilku latach takich prób odważył się on opublikować pierwszy układ okresowy, w którym zebrane już było ponad 90 pierwiastków (rok 1869).
Przełomowym pomysłem Mendelejewa było pozostawienie pustych miejsc tam gdzie występowały duże różnice między masami atomowymi znanych ówcześnie pierwiastków i jednocześnie zakłócona była regularność ich właściwości chemicznych. Tak skonstruowany układ okresowy był już trudny do zignorowania przez innych chemików, gdyż umożliwiał przewidywanie masy atomowej i właściwości jeszcze nie odkrytych pierwiastków. Mendelejew przewidział istnienie 8 pierwiastków, z których trzy odkryto jeszcze za jego życia (german, gal i skand) i miały one taką masę atomową i właściwości, jak wynikało to z jego układu okresowego. (…)”